top of page
盧創
工作室


讓創意落地,發揮影響力
將深度科學、商業洞察與職涯策略,轉化為清楚且可執行的下一步。

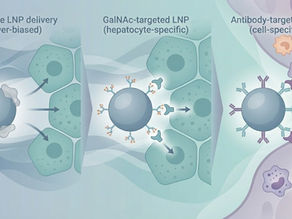
Targeted LNP Delivery:從 GalNAc 到抗體導向的下一代核酸遞送策略
前言:LNP 的下一個瓶頸,不是包得進去,而是「送對地方」 脂質奈米粒子(Lipid Nanoparticles, LNPs)已成功支撐 mRNA 疫苗與多項核酸藥物上市,證明其在體內遞送脆弱核酸分子的可行性。然而,隨著適應症從肝臟擴展至免疫細胞、中樞神經系統與實體腫瘤, 「非專一性體內分佈」正逐漸成為 LNP 發展的主要限制 。 對多數 LNP 平台而言,問題已不再是「能不能表現」,而是: 是否需要過高劑量才能達到目標組織 是否造成不必要的 off-target exposure 是否壓縮了治療指數(therapeutic window) 在這樣的背景下, targeted LNP delivery(目標導向式 LNP 遞送) 成為下一代核酸藥物平台的關鍵戰場。 為什麼多數 LNP 會「自然地」累積在肝臟? 在討論 targeted LNP 之前,有一個基本事實必須先釐清: 多數系統性給藥的 LNP,並非「被設計送去肝臟」,而是「被生物系統帶去肝臟」。 LNP 進入體循環後,會快速吸附血清蛋白,特別是 apolipoprotein E(Apo

Jason Lu
1月18日讀畢需時 4 分鐘


高通量 LNP 篩選技術:條碼化(Barcoding)如何改變脂質奈米粒子研發
前言:核酸藥物真正的瓶頸,其實在「遞送」 mRNA 疫苗、siRNA 藥物、CRISPR 基因編輯等核酸藥物,已經徹底改變了現代醫療。然而,這些療法能否真正成功,關鍵往往不只在於「序列設計」,而是在於—— 核酸能不能被有效、安全且精準地送到正確的細胞與器官 。 脂質奈米粒子(Lipid Nanoparticles, LNPs)目前仍是核酸藥物體內遞送的主流平台。透過包覆脆弱的核酸分子、避免體內降解,並促進細胞吸收,LNP 技術促成了 Onpattro® 、 Comirnaty® 與 Spikevax® 等關鍵產品的成功。 但 LNP 的設計本質上是一個高度多變、難以直覺優化的工程問題 。 離子化脂質的化學結構、脂質比例、PEG 密度、脂肪酸尾端設計,只要稍有不同,就可能徹底改變: 體內分佈(biodistribution) 轉染效率 免疫反應與毒性輪廓 過去,LNP 的篩選大多仰賴「一種配方對應一隻動物」的方式,搭配螢光或 luciferase reporter。這樣的流程不僅成本高、耗時長,也嚴重限制了可探索的配方空間。 近年來, DNA

Jason Lu
1月18日讀畢需時 5 分鐘
bottom of page